作者:info
4月24日,CDE官网显示,浙江京新药业1类新药安达西尼胶囊上市申请获国家药监局受理,用于治疗失眠障碍。
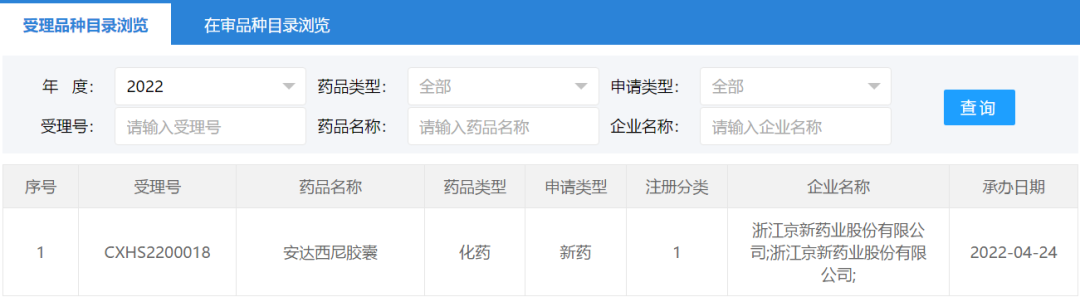
安达西尼胶囊(即EVT201胶囊)是治疗失眠障碍的1类小分子新药,属于新型GABAa受体部分正向别构调节剂(Partial positive allosteric modulator, pPAM),通过与α1-亚型结合导致GABAa受体的变构调节而中度激活该受体并导致下游信号转导,从而抑制中枢神经系统,发生睡眠作用。
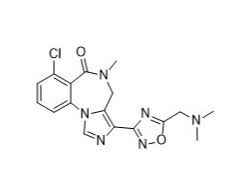
EVT201结构式
与GABAa受体的完全激活剂相比,EVT201胶囊对GABAa受体产生了较低的最大激活效价强度(Maximal activation potency),这种作用机制使EVT201胶囊既能对GABAa受体产生激活作用,而对神经系统发生迅速抑制,又能避免对GABAa受体过度激活而产生深度抑制引发神经副作用。与传统的GABA受体完全激动剂相比,在运动障碍、后遗效应、耐受性、乙醇相互作用、身体依赖性、记忆力损伤等不良反应方面,具有明显的优势。
EVT201最初由德国Evotec公司开发,2010年10月,两家公司签署了许可和合作协议,根据该协议,Evotec公司给予京新药业EVT201在中国区域的独家专利许可和开发权,京新药业负责在中国开发注册EVT201并销售该化合物的制剂。
京新药业于2021年11月完成该药品的III期临床试验,达到主要终点和次要终点,JX202001-EVT201-III研究是一项评价EVT201胶囊对比安慰剂在失眠障碍患者中疗效和安全性的多中心、随机、双盲III期临床研究。由首都医科大学宣武医院王玉平教授担任主要研究者,全国共77家中心共同参与。
研究共入组546例受试者,将受试者随机分入试验组或对照组,分配比例为2:1。主要研究终点是双盲治疗期第13/14晚整夜多导睡眠图(PSG)监测的平均总睡眠时间(TST),次要研究终点包括双盲治疗期客观维度(PSG监测)和主观维度(睡眠日记卡)的平均持续睡眠潜伏期、平均睡眠效率、平均睡眠觉醒时间、平均睡眠觉醒次数,以及包括撤药反跳评价、日间嗜睡评估、认知功能评估、疲劳程度评价等安全性指标。
基于统计分析模型,以第13/14晚PSG监测的平均TST值为反应变量,基线 TST、年龄为协变量,组别为自变量计算,EVT201胶囊组相对于安慰剂组的优效性成立,EVT201胶囊可快速起效、提高睡眠效率,同时改善次日嗜睡等残 留效应。
目前失眠障碍治疗药物主要包括地西泮、氯硝西泮等在内的苯二氮卓类,以及唑吡坦(国内1995年上市)、右佐匹克隆(国内2007年上市)为代表的新型非苯二氮卓类。此后,国内无新药获批上市。
安达西尼是京新药业首个小分子创新药上市申请,标志着其创新药研发取得了里 程碑进展,若该产品能顺利获批上市,将为失眠患者提供更优的用药选择。截止目前,该公司在该药品上累计已投入研发费用约为2亿元。