PART.01
背景
心血管疾病(CVD)的全球发病率和致死率常年居高不下,约占全球死亡人数的三分之一,且在肥胖、血脂异常、II型糖尿病、高血压等代谢类危险因素的作用下,已成为公共卫生及家庭生活的巨大挑战和沉重负担。
其中动脉粥样硬化性心血管疾病(ASCVD)受到人们的关注尤甚,ASCVD临床表现的缺血性心脏病和脑卒中是导致死亡的主要原因,占心血管疾病病例死亡的84.9%。预计到2030年,CVD患者的年死亡人数将增加到近2400万,ASCVD患者经历的心梗或卒中与血浆中的高胆固醇含量密不可分。
高胆固醇与心血管事件风险增加的相关性主要与低密度脂蛋白-胆固醇(LDL-C)有关,LDL由极低密度脂蛋白颗粒(VLDL)转化而来,LDL携带胆固醇形成LDL-C转运到外周组织,也包括功能失调的内皮下方的血管壁,在血管壁下的空间氧化应激,促使LDL氧化成ox-LDL,后者激活巨噬细胞的炎性小体(NLRP3)来增强血管炎症和ASCVD。
他汀类药物(如立普妥)是旨在阻断胆固醇合成的临床一线疗法,作为胆固醇合成限速酶——3-羟基-3甲基戊二酰辅酶A(HMG-CoA)还原酶的抑制剂,他汀类药物可以强效地降低总胆固醇(TC)和低密度脂蛋白(LDL)。但这种疗法对于成人原发性高胆固醇血症 (杂合子家族HeFH、非杂合子家族HoFH)以及对他汀类药物不耐受的患者来说并不合适,这类患者通常需要额外的降脂药物来达到LDL-C目标值。
PART.02
PCSK9的发现
因此,当2003年Catherine Boileau领导的法国团队和Nabil G Seidah领导的加拿大团队共同合作揭示了人类前蛋白转化酶枯草溶菌素9(PCSK9)编码常染色体显性家族性高胆固醇血症 (FH3) 的第三个基因,并且独立于LDLR(低密度脂蛋白受体)和载脂蛋白B( APOB ) 基因对 LDL-C进行调节后,PCSK9有三个结合域:
Prodomain (aa 31-152);
催化域 (aa 153-421);
铰链-CHRD域 (aa 422-692) 。
PCSK9和LDLR主要分别通过它们的催化结构域和EGF-A结构域相互作用,而PCSK9的 CHRD是触发LDLR降解所必需的,这引发了国内外药企对PCSK9抑制剂的研发热潮:Monogenic Pharmaceuticals、 AFFiRiS、 AstraZeneca、 Betagenon、 Merck、 Pfizer及国内企业信达、柯菲平、恒瑞、君实、信立泰、瑞博生物等均在该领域进行布局。
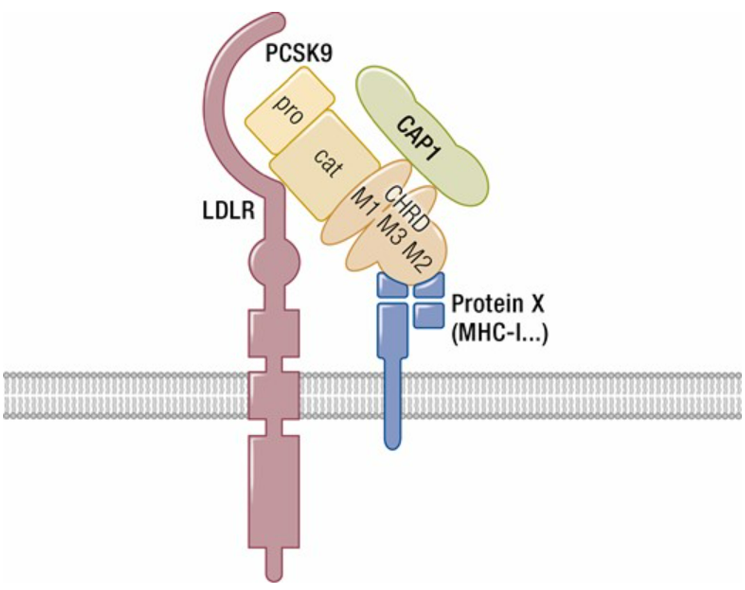
图1. PCSK9及其潜在结合位点示意图
PART.03
现有的PCSK9抑制剂药物
PCSK9抑制剂降低循环LDL-C水平主要通过两种机制:
1.破坏PCSK9与LDLR的复合物的形成;
2.直接抑制PCSK9的合成。
单克隆抗体或模拟抗体蛋白物均是通过直接抑制PCSK9和LDLR的结合来清除LDL-C,目前单抗类药物仍是PCSK9抑制剂的主场,除了国内已上市的Praluent(阿利西尤单抗)和Repatha(依洛尤单抗),在研的还有信达的Tafolecimab、君实的昂戈瑞西、恒瑞的SHR-120、信立泰的SAL003、天士力的B1655等等。
小分子肽类药物可以作用于PCSK9蛋白催化部位,使其变构进而也影响PCSK9和LDLR的结合,默沙东(MSD)开发的MK-0616——一款口服小分子PCSK9抑制剂,就是这样一种可通过消化道吸收合成的小分子环状肽类,目前仍在I期临床研究中。
在另一种机制——抑制PCSK9的合成中,阿斯利康和Ionis合作的AZD8233是一款PCSK9靶向反义寡核苷酸(ASO)药物,用于靶向抑制肝细胞内PCSK9 mRNA的翻译和蛋白合成。同样的小干扰RNA(siRNA)也通过基因沉默作用来抑制PCSK9合成。
PART.04
Leqvio
基于siRNA机制的PCSK9抑制剂
诺华的降脂药物——Inclisiran,商品名(Leqvio)于2020年9月通过欧盟审批上市并于2021年12月13日通过美国食品药品监督管理局(FDA)的审批,成为全球首个以RNAi疗法降胆固醇(LDL-C)的注射类创新药,也是全球上市的PCSK9抑制剂三款药物之一。
Leqvio进入肝细胞后,与RNA诱导沉默复合体(RISC)结合,并在反义链的介导下与编码PCSK9蛋白的mRNA结合,通过干扰了表达与互补的核苷酸序列的特定基因的转录后降低PCSK9的mRNA水平,阻止肝脏中PCSK9蛋白的表达,从而减少LDLR-PCSK9复合物被胞吞后LDLR在溶酶体中的降解,通过增加循环中的LDLR数量来增强肝脏从血液中清除LDL-C的能力,实现了降低LDL-C水平的目标。
在双盲、随机、安慰剂对照、为期18个月(540天)的III期临床试验中,主要涵盖了Leqvio治疗3655名杂合子型家族性高胆固醇血症患者(ORION-9)、以及在接受他汀治疗后仍需额外降低LDL-C的动脉粥样硬化性心血管疾病 (ASCVD) 患者(ORION-10)和ASCVD或ACSVD等危症患者 (ORION-11)的结果。
研究的主要终点是LDL-C从基线至第510天的百分比变化,以及LDL-C从第90天(基线)至最长第540天的基于时间调整的百分比变化。所有三项研究均达到主要终点。同时,也评估了药物在540天内的安全性。与安慰剂相比,接受Leqvio治疗的CeVD患者的LDL-C从基线至第510天平均降低了55.2%(P<0.0001)。
PART.05
一年两针的Leqvio
将使PCSK9抑制剂的赛道更加拥挤?
2021年,Leqvio的销售收入就达1200万美元(如图2),Leqvio的初表现与已上市的赛诺菲/再生元的Praluent和安进的Repatha相比也十分亮眼,这有可能是因为Leqvio的患者依从性更佳:
在初始治疗后3个月使用第二针,之后每年两针即可控制低密度脂蛋白胆固醇保持在50-60%之间;
而Praluent和Repatha均需每月注射两次。
GlobalData分析师曾预测,到2027年Leqvio可能会因其治疗便利性使诺华获得25亿美元的收益,超过Praluent和Repatha到2027年的预计销售额。
目前,Leqvio仍在进行一项测试心血管治疗的试验,预计2026年完成,Leqvio是否能获得美国FDA心血管适应症的批准将是我们继续关注的重点。
图2. 已获批准的20+个药物管线产品
结语
已经实施药品带量集采的他汀类药物对于降胆固醇可以说是性价比最高的治疗药物,对于家族性高胆固醇血症、确诊心血管疾病或他汀类药物不耐受的成人患者,PCSK9抑制剂单用或与他汀类药物的联用仍然存在一定的竞争力。
单抗类药物的研发成本是其定价高昂的主要原因,势必会增加患者的经济负担;口服类PCSK9抑制剂患者依从性最佳,但其研发过程还有很长一段路要走,毕竟口服制剂的低生物利用度仍是一个绕不开的问题,而且其生产成本也会高于注射剂。
高昂的药物定价、剂型选择和生物利用度这些现状问题对于PCSK9抑制剂的发展都是各大药企面临的共同挑战。
参考资料(可上下滑动):
1.Erratum: Department of Error. (2018). Lancet (London, England), 392(10160), 2170. https://doi.org/10.1016/S0140-6736(18)32833-2
2.American Heart Association Statistics Committee and Stroke Statistics Subcommittee, Executive Summary: Heart Disease and Stroke Statistics--2016 Update: A Report From the American Heart Association Circulation, 133 (2016), pp. 447-454
3.Duewell, P., Kono, H., Rayner, K. J., Sirois, C. M., Vladimer, G., Bauernfeind, F. G., Abela, G. S., Franchi, L., Nuñez, G., Schnurr, M., Espevik, T., Lien, E., Fitzgerald, K. A., Rock, K. L., Moore, K. J., Wright, S. D., Hornung, V., & Latz, E. (2010). NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals. Nature, 464(7293), 1357–1361. https://doi.org/10.1038/nature08938
4.Singh, A., Gupta, A., Collins, B. L., Qamar, A., Monda, K. L., Biery, D., Lopez, J., de Ferranti, S. D., Plutzky, J., Cannon, C. P., Januzzi, J. L., Jr, Di Carli, M. F., Nasir, K., Bhatt, D. L., & Blankstein, R. (2019). Familial Hypercholesterolemia Among Young Adults With Myocardial Infarction. Journal of the American College of Cardiology, 73(19), 2439–2450. https://doi.org/10.1016/j.jacc.2019.02.059
5.Bekkering, S., Stiekema, L., Bernelot Moens, S., Verweij, S. L., Novakovic, B., Prange, K., Versloot, M., Roeters van Lennep, J. E., Stunnenberg, H., de Winther, M., Stroes, E., Joosten, L., Netea, M. G., & Riksen, N. P. (2019). Treatment with Statins Does Not Revert Trained Immunity in Patients with Familial Hypercholesterolemia. Cell metabolism, 30(1), 1–2. https://doi.org/10.1016/j.cmet.2019.05.014
6.Seidah, N. G., & Prat, A. (2021). The multifaceted biology of PCSK9. Endocrine reviews, bnab035. Advance online publication. https://doi.org/10.1210/endrev/bnab035
Nassoury, N., Blasiole, D. A., Tebon Oler, A., Benjannet, S., Hamelin, J., Poupon, V., McPherson, P. S., Attie, A. D., Prat, A., & Seidah, N. G. (2007). The cellular trafficking of the secretory proprotein convertase PCSK9 and its dependence on the LDLR. Traffic (Copenhagen, Denmark), 8(6), 718–732. https://doi.org/10.1111/j.1600-0854.2007.00562.x
7.Zhang, D. W., Garuti, R., Tang, W. J., Cohen, J. C., & Hobbs, H. H. (2008). Structural requirements for PCSK9-mediated degradation of the low-density lipoprotein receptor. Proceedings of the National Academy of Sciences of the United States of America, 105(35), 13045–13050. https://doi.org/10.1073/pnas.0806312105
8.Horton, J. D., Cohen, J. C., & Hobbs, H. H. (2009). PCSK9: a convertase that coordinates LDL catabolism. Journal of lipid research, 50 Suppl(Suppl), S172–S177. https://doi.org/10.1194/jlr.R800091-JLR200
9.https://www.fda.gov/drugs/news-events-human-drugs/fda-approves-add-therapy-lower-cholesterol-among-certain-h
10.Wright, R. S., Ray, K. K., Raal, F. J., Kallend, D. G., Jaros, M., Koenig, W., Leiter, L. A., Landmesser, U., Schwartz, G. G., Friedman, A., Wijngaard, P., Garcia Conde, L., Kastelein, J., & ORION Phase III Investigators (2021). Pooled Patient-Level Analysis of Inclisiran Trials in Patients With Familial Hypercholesterolemia or Atherosclerosis. Journal of the American College of Cardiology, 77(9), 1182–1193.
11.https://www.novartis.com.cn/news/nuo-hua-inclisiranzai-dong-mai-zhou-yang-ying-hua-xing-xin-xie-guan-ji-bing-%28ascvd%29ya-zu-zhon-0
12.Novartis' Leqvio to reap $2.5B by 2027 thanks to convenience edge over Amgen, Sanofi rivals: analyst






